Comment s’oxydent les alliages d’or et d’argent ?
Il existe deux circonstances où les métaux précieux doivent être portés à température relativement élevée (entre 600 et 800° C) au cours de leur travail.
D’abord lorsqu’ils ont été durcis par écrouissage et qu’il s’agit de leur rendre leur malléabilité, pour pouvoir continuer à les déformer sans difficulté.
Enfin, au cours des opérations de brasage ou de soudage.
 Très souvent, ces opérations sont effectuées sans précaution particulière, à l’air, et le métal se recouvre d’une couche d’oxyde. Dans le cas d’un alliage d’or, cet oxyde peut être enlevé par décapage dans une décroche acide (retrouvez nos produits de déroche ici ) et on constate alors que la couleur est parfois modifiée. L’or rose par exemple est devenu jaune. Avec l’argent d’orfèvrerie 1er titre, on voit apparaître des taches sombres sur le métal, les taches de feu.
Très souvent, ces opérations sont effectuées sans précaution particulière, à l’air, et le métal se recouvre d’une couche d’oxyde. Dans le cas d’un alliage d’or, cet oxyde peut être enlevé par décapage dans une décroche acide (retrouvez nos produits de déroche ici ) et on constate alors que la couleur est parfois modifiée. L’or rose par exemple est devenu jaune. Avec l’argent d’orfèvrerie 1er titre, on voit apparaître des taches sombres sur le métal, les taches de feu.
Avec d’autres alliages d’argent, les phénomènes peuvent revêtir d’autres aspects.
Quelle est la nature profonde de ces phénomènes d’oxydation ? Comment les éviter ou corriger leurs effets ?
Telles sont les questions auxquelles nous voudrions tenter de répondre dans cet article !
La diffusion dans les solides
Avant toute chose, disons quelques mots du phénomène physique qui confère à l’oxydation les divers aspects qu’elle peut présenter, le phénomène dit de « diffusion ». La diffusion dans un solide est la propriété que possèdent les atomes constituant ce solide de se déplacer.
On l’observe particulièrement bien dans le cas des alliages. S’il existe des régions de titres différents, les atomes se déplacent des régions où leur concentration est la plus élevée, vers les régions où leur concentration est moindre.
Par exemple, si on argente par électrolyse un objet en or fin et qu’on le chauffe, on observe au bout de peu de temps un changement radical d’aspect. Le métal argenté blanc est devenu vert.
Il s’est formé en surface un alliage or-argent : des atomes d’argent ont pénétré dans l’or et ils ont été remplacés par des atomes d’or qui progressaient dans la direction opposée. Le même phénomène se serait produit si deux alliages de titre différents avaient été plaqués l’un sur l’autre.
La diffusion tend à homogénéiser les alliages.
L’oxydation
L’oxydation d’un métal est la transformation de ce métal en oxyde, par réaction avec l’oxygène, le plus souvent celui de l’air. Si on chauffe du cuivre à l’air, il se recouvre d’une couche d’abord rouge d’oxydule, puis noire d’oxyde. L’or et l’argent fins par contre ne changent pas de teinte. Ils ne réagissent pas avec l’oxygène de l’air pour former un oxyde.
Le cas de l’argent est cependant particulier, car il peut dissoudre l’oxygène, qui diffuse peu à peu de la surface exposée à l’air vers l’intérieur. Nous y reviendrons tout à l’heure.
Donc, l’or n’est pas oxydable, alors que le cuivre, lui, s’oxyde facilement. Lorsque l’on chauffe à l’air un alliage or-cuivre, ce sont d’abord les atomes de cuivre de la surface, en contact direct avec l’oxygène de l’air, qui se transforment en oxyde. L’oxyde de cuivre n’est pas du cuivre. La surface de l’alliage présente donc une concentration nulle en cuivre, dès le premier temps de l’oxydation. Le phénomène de diffusion entre alors en jeu dans le métal, les atomes de cuivre se déplaçant de l’intérieur, où ils se trouvent à la concentration initiale, vers la surface où ils sont aussitôt consommés, pour former l’oxyde.
Il y a un véritable « pompage » de cuivre de l’intérieur vers la surface, les atomes les plus vite pompés étant les plus proches de la surface.
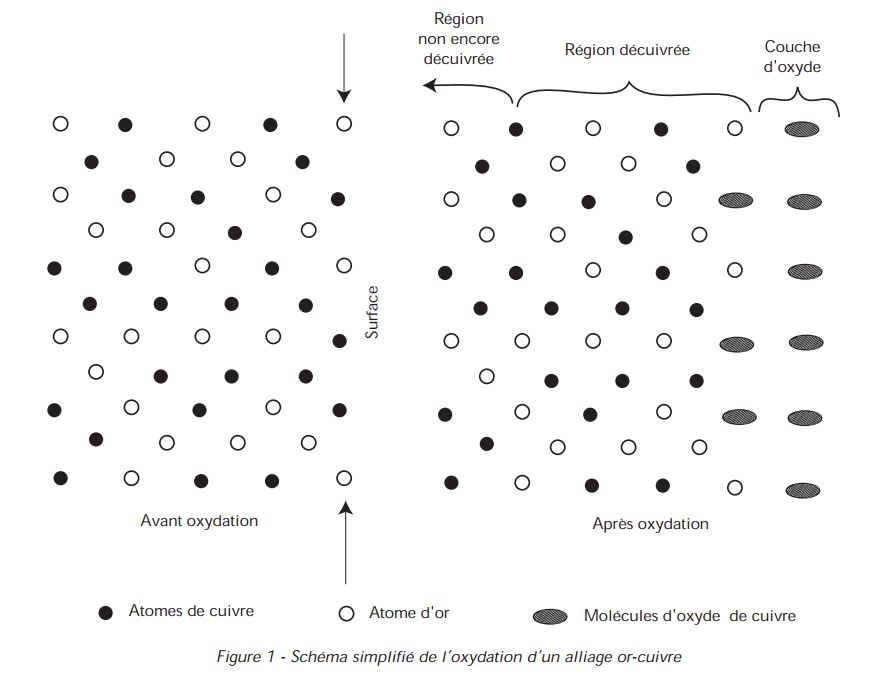
En somme, si l’on arrête l’opération et que l’on effectue une coupe de l’alliage Or-Cuivre, on peut observer :
- Sur la surface, une couche d’oxyde,
- La surface elle-même exempte de cuivre libre,
- Au dessous de la surface, une concentration croissante en cuivre, jusqu’à la valeur initiale, qu’on retrouve à une certaine profondeur (trop éloignée de la surface pour avoir été affectée par la diffusion). Si le métal, dans cet état, est déroché, c’est-à-dire, si l’on élimine la couche d’oxyde, la surface présentera l’aspect correspondant à sa composition, c’est-à-dire l’aspect de l’Or fin.
Avec un alliage Or-Argent-Cuivre :
Avec un alliage or-argent-cuivre, un or rose à 18 carats, par exemple, le phénomène présente la même allure : le cuivre s’élimine en surface par formation d’oxyde.
Si l’on décape, l’aspect est celui d’un alliage décuivré, c’est-à-dire jaune. Si on polit, on enlève par abrasion la couche superficielle appauvrie en cuivre et on retrouve l’alliage initial (figure 1).
Pour éviter le changement de teinte, il faut éviter de « sortir » le cuivre des couches superficielles par oxydation, il faut donc opérer dans une atmosphère privée d’oxygène.
Dans l’industrie, on utilise des fours de recuit spécialement conçus, avec des atmosphères protectrices formées d’azote et d’hydrogène, ou de gaz carbonés.
Plus simplement, on peut enfermer les pièces dans des coffrets en fer contenant des copeaux de fonte, qui fixent l’oxygène présent avant le cuivre.
Dans les opérations de soudage ou de brasage, on peut utiliser des flux, tels que le borax ou l’acide borique ou, encore mieux, des chalumeaux alimentés par des gaz chargés de composés gazeux de l’acide borique.
Il se forme ainsi sur la pièce, partout où elle entre en contact avec la flamme, une mince couche protectrice d’acide borique fondu.
Avec l’argent :
L’argent, avons-nous dit, constitue un cas à part puisqu’il peut dissoudre l’oxygène. Lorsque de l’argent fin est chauffé à l’air, son aspect ne change pas mais en fait il s’enrichit en oxygène, qui chemine peu à peu de la surface vers l’intérieur, par diffusion.
Dès lors, dans le cas des alliages d’argent chauffés à l’air, des alliages argent-cuivre, par exemple, deux diffusions, dans des directions opposées sont possibles : diffusion du cuivre de la surface vers l’intérieur, diffusion de l’oxygène de la surface vers l’intérieur.
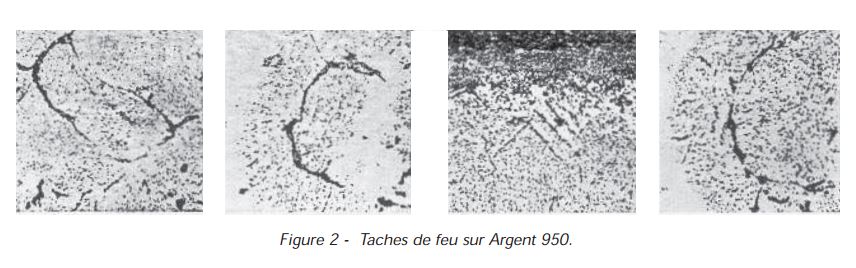
Si la vitesse du cuivre est plus grande que celle de l’oxygène, il se forme une couche superficielle d’oxyde. Si la vitesse de l’oxygène est plus grande, il pénètre dans l’alliage où il oxyde le cuivre. C’est le phénomène « d’oxydation interne ». Si on observe au microscope une coupe de ce métal oxydé, on voit nettement les grains d’oxyde formés (fig. 2)
Extérieurement, l’argent a pris une teinte sombre, il s’est crée une « tache de feu ».
La vitesse de diffusion du cuivre est d’autant plus grande que sa concentration est elle-même plus grande. C’est donc sur les alliages riches en cuivre, comme par exemple l’argent à 835 ‰, que l’on observe la formation de couches noires d’oxyde de cuivre.
Par contre, les taches de feu, par oxydation interne, apparaissent sur les alliages plus dilués, comme l’argent premier titre.
Nous avons rassemblé les résultats de nos propres observations au sein du laboratoire Cookson-CLAL,
sous forme de courbes (figure 3) qui donnent les profondeurs de pénétration de l’oxygène, donc les profondeurs des taches de feu, en fonction du temps et de la température.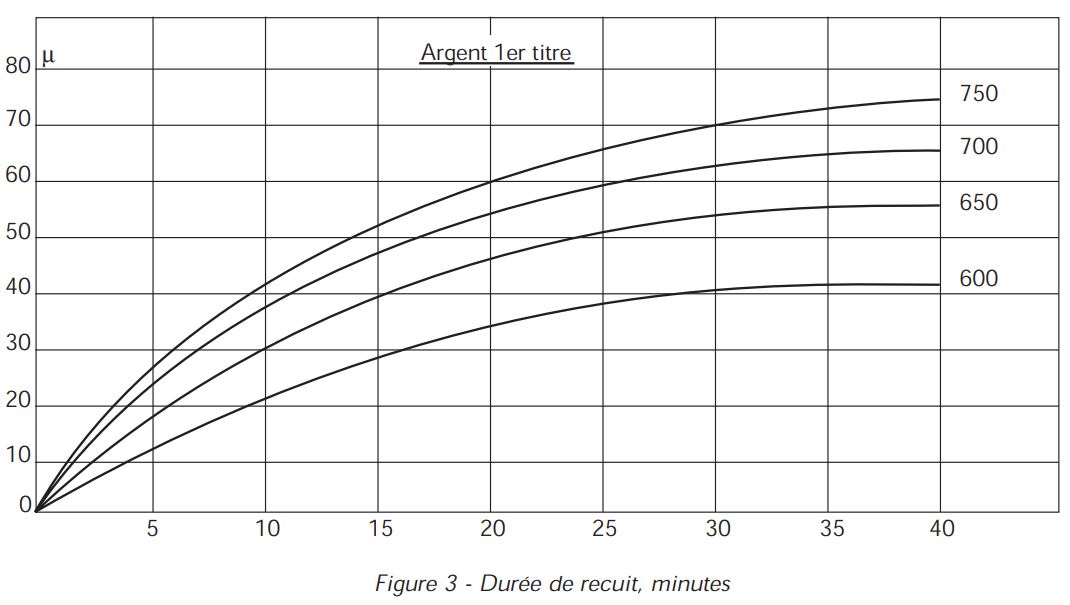 On voit par exemple que le chauffage de l’argent 1er titre à l’air, à 750°C pendant 10 minutes, provoque la formation d’une tache de 42 microns, soit 0.042 mm d’épaisseur.
On voit par exemple que le chauffage de l’argent 1er titre à l’air, à 750°C pendant 10 minutes, provoque la formation d’une tache de 42 microns, soit 0.042 mm d’épaisseur.
Que faire contre les taches de feu de l’argent ?
Contre les taches de feu de l’argent 1er titre, il y a un remède et deux palliatifs :
- Le remède est d’éviter l’oxydation par l’emploi d’une atmosphère ou d’une protection convenable et nous renvoyons à ce qui a été dit plus haut, au sujet des alliages d’or.
- Le premier palliatif est de masquer la tache de feu par un dépôt galvanique d’argent fin. (Retrouvez notre gamme pour galvanoplastie).
- Le second est d’enlever le métal par polissage (Retrouvez tous le matériel de polissage ici). Mais on sait ce qu’une telle chirurgie a de pénible pour l’orfèvre et de mutilant pour l’objet !
Les taches de feu arrivent aussi à se former dans les alliages d’argent qui s’oxydent par formation d’une couche d’oxyde.
En effet on observe le même phénomène que dans les alliages d’or, c’est-à-dire un appauvrissement du métal en constituant oxydable sous la surface.
Par exemple, l’argent deuxième titre se recouvre par oxydation d’une couche d’oxyde de cuivre, mais les régions sous-jacentes voisines du métal s’appauvrissent en cuivre et, dès lors, il est possible à l’oxygène d’y pénétrer et de donner lieu au phénomène d’oxydation interne.
Aussi, après décapage, ce n’est pas la belle surface de l’alliage initial qui risque de se présenter, mais une surface terne. La figure 4, montre la profondeur de pénétration de l’oxygène dans l’argent deuxième titre recuit à l’air, en fonction de la température et de la durée de recuit. On voit que la vitesse de croissance des taches de feu dans cet alliage est quand même plus faible que dans l’argent 1er titre.
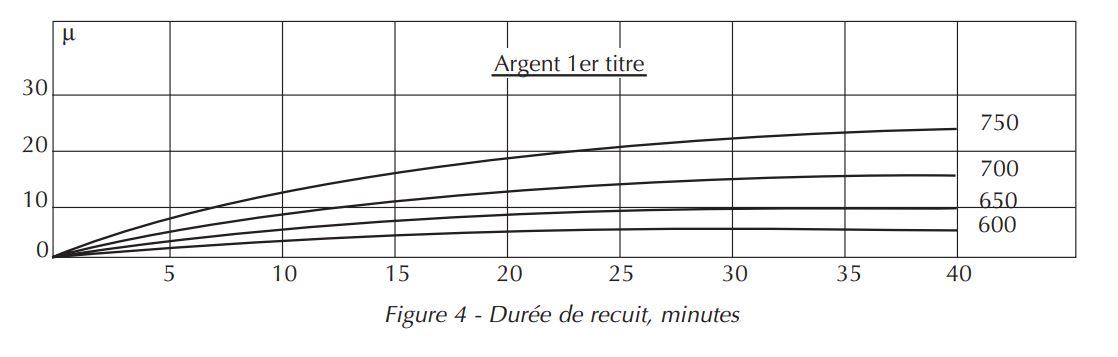
Mentionnons ici un autre aspect du phénomène précédent. Soit un alliage deuxième titre qui a été oxydé et décapé. Il est donc recouvert d’une couche d’argent fin où sont occlus des grains d’oxyde de cuivre. Cette couche se comporte vis-à-vis de l’oxygène comme une couche d’argent fin où l’oxygène peut se diffuser très vite.
Si on procède à un nouveau recuit de ce métal décapé, qu’une couche d’oxyde n’isole pas du contact direct avec l’oxygène de l’air, celui-ci commence par diffuser très vite dans la couche superficielle jusqu’à ce qu’il parvienne à l’alliage riche, situé juste en dessous, où l’oxygène ne peut diffuser.
Il se forme alors une couche d’oxygène, en sandwich entre l’alliage peu ou pas décuivré et la couche superficielle décuivrée.
Le métal, apparemment, reste blanc, mais il suffit de très peu de chose pour que la couche d’argent fin se décolle, pèle et découvre la couche noire qu’elle masquait.
Les phénomènes d’oxydation peuvent donc revêtir bien des aspects. Vu leur importance pratique, ils font l’objet d’études scientifiques poussées et de nombreux articles leur ont déjà été consacrés.
Nous ne les avons décrits ici que d’une manière simplifiée, pour donner une image concrète de ce qui se passe dans des cas qui nous sont familiers,
et pour aider ainsi les bijoutiers à résoudre leur problèmes quotidiens.
Contactez-nous pour plus d’informations techniques et métallurgiques !